Poznámky ze summitu GMFH 2023 - 11. Světový summit Gut Microbiota For Health (GMFH) se konal od 11. do 12. března 2023 v Praze. Summit byl tento rok zaměřený na “The next generation of microbiome-based therapy and nutrition” neboli „Budoucí generace terapie a nutrice založená na mikrobiomu.“
Díky přítomnosti řady přednášejících, kteří jsou nám známí jen díky studiím prezentovaných v časopisech Nature, Science, Gut a dalších, byl summit mimořádně vzrušující. Summit měl nejen plenární zasedání, ale také intenzivní workshopy zaměřené na vývoj probiotik nové generace, vliv mikrobioty na onemocnění jater, na problematiku efektu tradiční západní diety na mikrobiom a taktéž na možnosti ovlivnění osy mozek-střevo.
Michael Scharl z University Hospital Zurich ve svém sdělení detailně popsal, jak střevní mikrobiota moduluje protirakovinnou imunitu a odpověď na léčbu. Ukázal také, že přítomnost Clostridiales je spojená s nižším výskytem nádorů na myších „modelech“ kolorektálního karcinomu (dále CRC). Je velmi zajímavé, že tyto komenzální druhy - Clostridiales - jsou také významně sníženy u pacientů s CRC ve srovnání se zdravou kontrolní skupinou. Perorální podání směsi čtyř kmenů Clostridiales (CC4) u myší zabránila progresi a dokonce úspěšně léčila CRC jako samostatná terapie. Tento účinek závisel na intratumorální infiltraci a aktivaci CD8 + T buněk. V přímém srovnání suplementace směsí CC4 překvapivě překonala anti-PD-1 terapii u myších modelů CRC a melanomu. Michaelova studie tak dává nový preklinický základ pro zkoumání střevních bakterií jako nové samostatné terapie proti solidním nádorům: "Mikrobiom moduluje odpověď na protinádorovou léčbu. První studie potvrzují léčebný efekt baktérií u nádorů…“
Harry Sokol ze Saint-Antoine Hospital v Paříži představil přínos Faecalibacterium prausnitzii pro naše zdraví. Bylo zjištěno, že Faecalibacterie prausnitzii (F. prausnitzii )jsou obvyklé u zdravých jedinců a mají protektivní funkci pro zdraví trávicího traktu a zároveň posilují imunitní systém, metabolismus i snižují střevní propustnost. Mají tak potenciál být terapeutickým cílem u nemocí spojených s mikrobiotou, jako jsou imunologické poruchy, IBD a také imunoterapie rakoviny: „Vysoká hladina F. prausnitzii je spojena s lepší odpovědí na léčbu u několika typů rakoviny…“
Gianluca Ianiro z Università Cattolica del Sacro Cuore v Římě prezentoval komplexní pohled na transplantaci fekální mikroflóry (FMT), která je nyní experimentálně prováděna i u neinfekčních onemocnění, včetně IBD, IBS, metabolického syndromu, neurologických onemocnění a dalších. Zatímco přenos „zdravé biomasy“ je velmi účinný bez ohledu na její složení u klostridiové kolitidy(což je typický příklad akutní dysbiózy), stále více studií potvrzuje, že klinický úspěch FMT u chronických poruch je ovlivněn řadou faktorů mezi které patří: 1. složení dárcovského mikrobiomu, 2. schopnost „přihojení“ do střeva příjemce nebo 3. rozdíly ve vlastních pracovních protokolech FMT. Popsal významnou variabilitu klinické účinnosti mezi dárcem a příjemcem a ukázal to na rozdílech v profilech dárcovských mikrobiomů vyšetřených sekvenováním celého bakteriálního genomu. Dárci a příjemci s ulcerózní kolitidou se významně lišili ve složení a funkci střevní mikroflóry. Ještě pozoruhodnější je, že stabilita v bohatosti dárcovských druhů je spojena s adekvátní terapeutickou účinností. Obecně tak platí jeho slova, že“ „Pro úspěch fekální transplantace jsou vždy rozhodující tři faktory: 1. Kondice dárce, 2. Stav příjemce i 3. Vlastní provedení transplantace. Vše ideálně personalizované.“
Karen L. Madsen z kanadské University of Alberta prezentovala vliv mikrobiomu na obezitu a využití FMT jako léčebného nástroje pro její léčbu. Popsala vliv vlákniny na přihojení dárcovské mikrobioty u FMT a taktéž význam jednotlivých baktérií na rozvoj obezity: „Mezi klíčové baktérie ovlivňující naši štíhlou postavu patří Akkermansia muciniphila, Faecalibacterium prausnitzii či Anaerobutyricum, což bylo potvrzeno ve studiích.“
Anne-Marie Cassard z Faculté de Pharmacie, Université Paris-Saclay v Paříži zaměřila svoji prezentaci na změny ve složení střevní mikroflóry (dysbiózu), které jsou pozorovány u závažných nutričních onemocnění jater, včetně non-alcoholic fatty liver disease (NAFLD) i alcoholic liver disease (ALD), a ukázala, že souvisí se závažností obou. Úpravy složení mikroflóry přenosem fekální mikroflóry nebo aplikací probiotik nebo prebiotik/vlákniny na myších modelech NAFLD a ALD prokázaly její přínos ke snížení progrese poškození jater: „Již 5gramů pektinu může výrazně ovlivnit průběh těžkého jaterního postižení a to jak u ALD, tak i NAFLD.“
Mahesh S. Desai z Department of Infection and Immunity, Luxembourg Institute of Health, v Lucemburku ve své práci popsal souvislost autoimunitních onemocnění (AD) a střevní mikrobioty. Kromě klasických rizikových faktorů pro AD, jako jsou genetické polymorfismy, infekce a kouření, jsou nyní zvažovány spouštěče z prostředí. Nedávné studie založené na sekvenování mikrobiomu odhalily, že nejen pacienti s intestinálními IBD, ale i s extraintestinálními AD, jako je roztroušená skleróza, revmatoidní artritida, diabetes typu 1 a systémový lupus erythematodes, mají odlišné složení střevní mikroflóry ve srovnání se zdravými jedinci. Vliv transplantace fekální mikroflóry nebo inokulace specifickými mikroby na zvířecích modelech AD podporuje hypotézu, že změny střevní mikroflóry ovlivňují autoimunitní reakce, progresi onemocnění i vlastní léčbu. V pražské prezentaci Mahesh ukazoval, jak by mohla být modulována střevní mikroflóra u pacientů s AD jako potenciální preventivní nebo terapeutický přístup: „Zásadní příčinou extrémního nárůstu zánětlivých onemocnění střeva (IBD), autoimunitních chorob (AD) i rakoviny střeva je 5násobný pokles konzumace vlákniny: z >50g/den na 10g/denně."
Matt Carter ze Sonnenburgovi laboratoře na Stanfordské univerzitě představil výsledky nejnovějšího výzkumu zaměřené na oligosacharidy mateřského mléka (HMO): „RAMP studie prokázala, že suplementace purifikovanými oligosacharidy mateřského mléka má pozitivní efekt nejen na složení mikrobioty a metabolismus, ale i na imunitní odpověď.“ HMO hrají zásadní roli při podpoře zdraví trávicího traktu a rozvoji mikrobiomu, poskytují přímou i nepřímou imunitní ochranu a podporují kognitivní funkce ve vyvíjejícím se mozku dítěte. Snad nejdůležitější je, že několik HMO se prokázalo jako bezpečné a vhodné jako doplněk ke kojení, nebo jako náhrada, když kojení není možné. Inovace, které rekapitulují rozmanitost struktur HMO přirozeně se vyskytujících v mateřském mléce, slibují zásadní přínos pro trávicí a imunitní zdraví a kognitivní vývoj kojenců krmených umělou výživou. Pokračující rozšiřování fortifikace HMO a charakterizace jejích účinků na zdraví kojenců zůstane ještě nějakou dobu možná nejvýznamnějším pokrokem v kojenecké výživě.
Meriem Messaoudene z Université de Montréal podrobně popsala možnosti mikrobiálních intervencí v oblasti imunoonkologie: „Určitý mikrobiom je charakteristický pro rakovinu. Nově může být i biomarkerem úspěšné léčby. A nyní i adjuvantní léčbou v podobě FMT, prebiotik, probiotik, postbiotik a personalizované diety." Prezentované výsledky naznačují, že narušení střevní mikroflóry a nepřítomnost určitých specifických druhů bakterií může interferovat s účinností protirakovinné léčby. Na modelech, kde byly myši s nádorem léčeny anti-CTLA-4 nebo anti-PD-L1, bylo skutečně prokázáno, že Bacteroides fragilis a Bifidobacterium stimulují Th1 lymfocyty a maturaci protinádorových dendritických buněk. Přítomnost bakterie Bifidobacterium také indukuje zvýšenou produkci IFNγ (interferon−γ). Výsledky studií potvrzují, že mikroflóra pacientů s pozitivní reakcí na léčbu obsahuje imunogenní bakterie, jako jsou A. muciniphila , Faecalibacterium a B. longum , které indukují funkční anti-PD-1/PD-L1 účinnost. Objevuje se nový terapeutický koncept, který naznačuje, že účinnost ICI by mohla být zlepšena modulací střevní mikroflóry. Navíc se objevují další bakterie jako Clostridiales, Enterococcus fecium, Eubacterium spp., Firmicutes a Ruminococcus spp., které jsou spojovány s lepší reakcí na protinádorovou léčbu, ale v menší míře než výše uvedené.
Yael Haberman z Sheba Medical Center v Israeli ve skvělé prezentaci popsala aktuální možnosti komplexní modulace léčby:
„Lidé jsou velmi různí a to i přes to, že 99% jich má identický genom a asi 30% shodný střevní mikrobiom. Existuje mnoho způsobů, jak intervenovat – ale je potřeba vědět jak.“ Mimo jiné ukázala, jak velký vliv má mikrobiota na metabolické a chronický zánětem způsobené nemoci jako je obezita, alergie/astma, eosinofilní ezofagitida, celiakie, autismus či Crohnova choroba. Vliv exposomu (vnějšího prostředí) výrazně přesahuje význam genetické predispozice u IBD, což Yael prezentovala na základě výsledků studie SOURCE (Study Of Urban Rural Crohn’s disease Evolution).
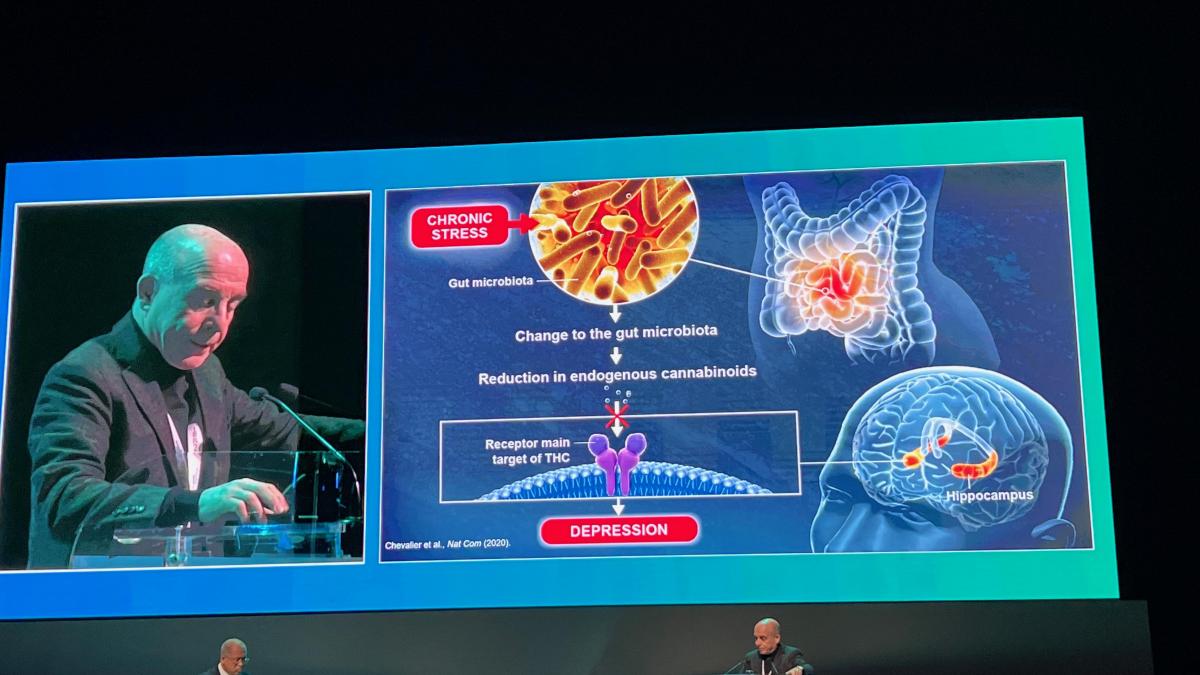
Úžasný řečník Piere-Marie Lledo z Institut Pasteur, Université Paris Cité v Paříži, skvěle popsal propojení mozku a střeva: „Pro vzájemné ovlivnění mozku a střeva platí: N. vagus posílá signály do střeva a naopak. Střevní baktérie produkují serotonin, který ovlivňuje náladu, spánek i koncentraci. Mozek veškeré signály interpretuje a vytváří naši náladu.“ Vzhledem ke dvojí roli, kterou hraje mozek, který využívá vzestupné a sestupné cesty ke kombinaci informací pocházejících z vnějšího světa a vnitřního prostředí, Pierova prezentace zpochybnila mozkově zaměřené vidění mozku. V našem každodenním životě vytváříme prezentaci vnějšího světa přeměnou chemických, tlakových a světelných vln na chutě, vůně, doteky, zvuky a pohledy. Při tom vytváříme naši zkušenost s vnějším světem interpretací našich smyslů prostřednictvím procesu zvaného exterocepce. Způsob, jakým mozek konstruuje naše vnitřní vjemy zvané interocepce je nyní neodhalený. Studie mozku tak projdou důležitou revolucí, která nově definuje hranice, aby prokázala holističtější propojení mozku, který kombinuje smyslové zážitky s tělesnou homeostázou. Ať už se jedná o jakoukoli niku, spojení mezi mikrobiotou a mozkem je zajištěno obvyklými cestami, včetně neurální, endokrinní, metabolické a imunitní signalizace. Například v souvislosti s osou střevo-mozek bylo prokázáno, že mikroby ovlivňují imunitní buňky a navazující zánětlivé reakce mohou ovlivnit mozek. Střevní mikrobiom navíc stimuluje buňky neuropodů ve střevní výstelce ke stimulaci bloudivého nervu (n. vagus), který se přímo připojuje k mozku. Alternativně mohou látky vylučované střevními bakteriemi do střeva přestupovat do krevních cév, aby se dostaly přímo do mozku, což může také představovat další aspekt osy střevo-mozek - potenciální roli mikrobiálních metabolitů působících přímo v mozku.